職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2024-12-31 瀏覽次數:50
2024年第47屆圣安東尼奧乳腺癌研討會(SABCS)于近日在美國圣安東尼奧舉行。期間,由中國醫學科學院腫瘤醫院馬飛教授團隊牽頭的“達爾西利聯合內分泌治療在HR+/HER2-晚期乳腺癌內臟危象患者中的探索性研究”的最新結果(摘要號為P2-09-28)精彩亮相。該研究達到了預設的主要終點,提示達爾西利聯合內分泌治療有望成為此類患者的新選擇[1]。
01研究背景
對于合并內臟危象的晚期乳腺癌患者,目前臨床上主要選擇化療,以達到快速控制疾病進展的目的[2]。然而,由于內臟危象患者通常伴器官功能障礙,臨床上很難選擇合適的化療方案。此外,內臟危象人群常常被排除在乳腺癌臨床試驗的研究對象之外,導致內臟危象的治療策略缺乏充分的前瞻性研究證據。因此,迫切需要新的治療選擇來改善這部分患者的預后。
達爾西利是恒瑞醫藥自主研發的1類新藥,也是中國首個自主研發的新型高選擇性CDK4/6抑制劑,于2021年12月獲國家藥監局批準上市,已在乳腺癌治療領域獲批兩個適應癥。
本研究旨在評估達爾西利聯合內分泌治療對比化療在HR+/HER2-晚期乳腺癌伴內臟危象患者中的療效與安全性。
02 研究方法
本研究為一項多中心、外部對照的Ⅱ期臨床試驗,試驗組采用Simon兩階段設計,旨在評估達爾西利聯合內分泌治療在HR+/HER2-晚期乳腺癌伴內臟危象患者中的療效與安全性。
內臟危象定義:胸腔積液,腹水,肝臟或腹膜轉移引起的腹痛,胸腔積液或肺淋巴管炎引起的呼吸困難,肝酶升高(>2×ULN),在無Gilbert綜合征或膽道梗阻的情況下,膽紅素快速升高(>1.5×ULN),病理學證實的骨髓轉移且血紅蛋白<100 g/L。
本研究中,試驗組受試者將接受達爾西利(150mg每日口服,前21天連續服藥,后7天停藥)聯合研究者選擇的內分泌治療(ET)方案。在研究第一階段,將入組18例受試者,若觀察到的6個月存活受試者數≥9例,則進入第二階段并繼續入組35例受試者。在總計53例受試者中,若6個月存活受試者數≥28例,則表明該方案值得進一步探索。
本研究使用真實世界數據作為外部對照組,選取接受化療的HR+/HER2-晚期乳腺癌內臟危象患者(CT組)。這些數據來源于各中心的醫院信息系統(HIS)。CT組的入組標準和排除標準與達爾西利+ET組相同。采用逆概率加權(IPTW)方法來評估試驗組的平均治療效應(ATT),并進行傾向評分調整,包括年齡、ECOG評分、復發、轉移部位數量、既往晚期化療線數和內臟危象類別。
本研究的主要終點為6個月總生存率(6個月OS)。次要終點包括:總生存期(OS)、無進展生存期(PFS)、客觀緩解率(ORR)、疾病控制率(DCR)、3個月治療失敗率(TFR)、至治療失敗時間(TTF)、疾病控制時間(DDC)以及不良事件(AE)和嚴重不良事件(SAE)的發生率及嚴重程度(圖1)。
圖 1 研究設計圖
03 研究結果
1.有效性結局
在2023年2月至2024年9月期間,在第一階段試驗組18例患者中,有17例患者的生存超過6個月。在進入第二階段53例患者中,49例患者的生存超過6個月,6個月生存率達到92.5%(95% CI,81.8-97.9),成功拒絕了原假設(≤44%)。其中11例(20.8%)達到部分緩解(PR),31例(58.5%)達到疾病穩定(SD),ORR達到20.8%(95% CI,10.8-34.1),DCR達到79.2%(95% CI,65.9-89.2)。3個月TFR為22.6%(95% CI,12.3-36.2)。
對CT組的157例患者數據進行分析。經IPTW調整后,有效樣本量約為50例(表1)。與CT組相比,達爾西利+ET組的中位PFS更長(中位10.74個月 vs. 4.63個月;HR=0.316[95% CI,0.191-0.521],P<0.0001),中位TTF也更長(中位9.46個月 vs. 4.14個月;HR=0.301[95% CI,0.184-0.494],P<0.0001)。達爾西利+ET組中位DDC為10.68個月,CT組中位DDC為5.03個月(圖2)。

表1 IPTW調整前后的基線特征
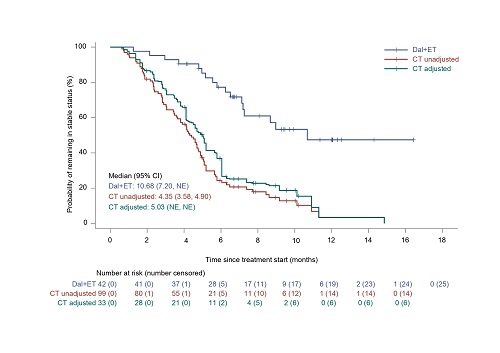


圖2 IPTW調整前后的PFS、TTF和DDC的KM曲線
2.治療相關不良反應
達爾西利聯合內分泌治療安全性可控,未觀察到新的安全性信號。
04 研究總結
本研究達到了預設的主要終點,達爾西利聯合ET組的6個月OS為92.5%。此外,與CT組相比,達爾西利聯合ET組顯著延長了患者的PFS和TTF。達爾西利聯合內分泌治療安全性可控,未觀察到新的安全性信號,提示達爾西利聯合內分泌治療有望成為HR+/HER2-晚期乳腺癌伴內臟危象患者的新治療選擇。
參考文獻:
[1] Hongnan M, et al. Dalpiciclib plus endocrine therapy for visceral crisis in hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: a multicenter, phase 2 study. 2024 SABCS P2-09-28.
[2] Gennari A, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol, 2021. 32(12): 1475-1495.
300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

